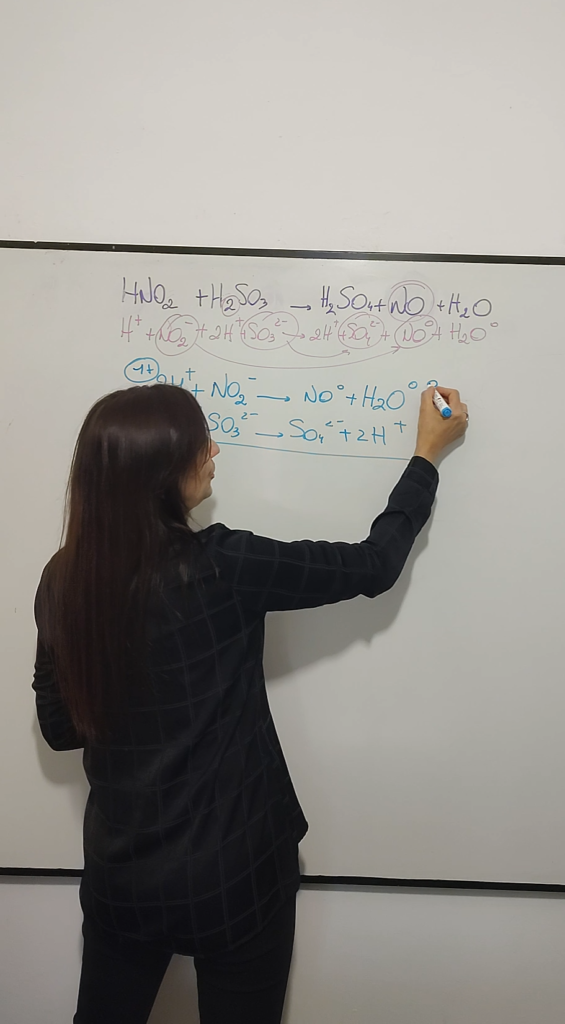Son reacciones químicas en las que ocurre un intercambio de electrones entre los átomos o moléculas involucrados.
![]() Ese intercambio se refleja en el cambio de estado de oxidación de los reactivos. El reactivo que cede electrones experimenta oxidación y el que los recibe, reducción.
Ese intercambio se refleja en el cambio de estado de oxidación de los reactivos. El reactivo que cede electrones experimenta oxidación y el que los recibe, reducción.
![]() En toda reacción redox hay dos tipos de reactivos, uno que cede electrones y otro que los acepta:
En toda reacción redox hay dos tipos de reactivos, uno que cede electrones y otro que los acepta:
![]() Un agente oxidante. Es el átomo que capta los electrones. En este sentido, disminuye su estado de oxidación inicial, y se experimenta una reducción. De esta forma, aumenta su carga eléctrica negativa al ganar electrones.
Un agente oxidante. Es el átomo que capta los electrones. En este sentido, disminuye su estado de oxidación inicial, y se experimenta una reducción. De esta forma, aumenta su carga eléctrica negativa al ganar electrones.
![]() Un agente reductor. Es el átomo que cede los electrones y aumenta su estado de oxidación inicial, experimentando una oxidación. De esta forma, aumenta su carga eléctrica positiva al ceder electrones.
Un agente reductor. Es el átomo que cede los electrones y aumenta su estado de oxidación inicial, experimentando una oxidación. De esta forma, aumenta su carga eléctrica positiva al ceder electrones.
Cómo ajustamos en medio ácido?
1. Disociamos todas las especies. NO disocian los óxidos, el agua y los elementos sin combinar.
2. Identificamos las especies que han cambiado, las que se oxidaron y las que se redujeron.
3. Ajustamos los elementos menos el oxígeno y el hidrógeno.
4. Donde falte oxígeno agregamos esa cantidad que falta en agua y del otro lado duplico en protones.
5. Ajustamos las cargas agregando electrones para que nos quede de los dos lados la misma carga.
6. Sumamos miembro a miembro las especies, simplificamos.
7. Trasladamos los coeficientes estequiométricos a las especies que correspondan en la fórmula original.
No te quedes sin entender este tema. Hablame y combinamos clases SOLO presenciales en Caba. ![]()
Para ver la explicación completa: https://www.instagram.com/reel/CjkrCoZjSRj/?igshid=YmMyMTA2M2Y=